Tipos de enlaces, puede referirse a la gramática, a una palabra que funciona como nexo, sintácticamente une palabras u oraciones.
También puede referirse a la química como dos átomos o mas unidos para la formación de una entidad superior.
Tipos de enlaces, en química
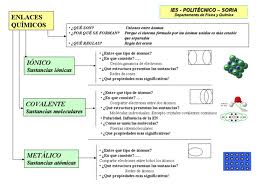
En química, los tipos de enlaces se refieren al proceso químico que tiene que ver con las interacciones entre las moléculas y los átomos que dará lugar a la estabilidad de los compuestos químicos poliatómicos y diatómicos. Lee tipos de reacciones químicas.
La química cuántica es la encargada de la descripción de estas fuerzas atractivas y lo hace a partir de Leyes.
Tipos de enlaces, iónicos
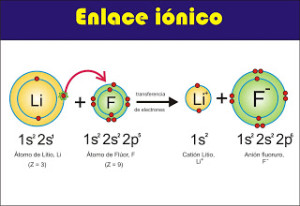
Los enlaces iónicos son logrados a partir de una atracción electroestática de los átomos con cargas eléctricas y signos contrarios.
Este tipo de enlace necesita que uno de los elementos ceda electrones al otro. Por ejemplo un elemento metal le cede electrones a uno no metal.
Tipos de enlaces, covalente
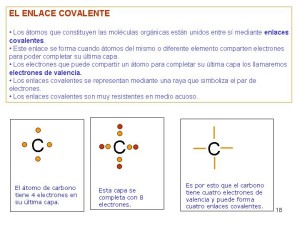
Se diferencian de los iónicos porque no transfieren electrones sino que los comparten.
De este modo los átomos son unidos por electrones que se ubican en las órbitas últimas. Se establecen entre los elementos no metales. Pueden ser:
Sustancias covalentes moleculares y las redes. Estas últimas son duras, sólidas y aislantes con una temperatura de fusión y ebullición alta.
Por su parte las sustancias covalentes son aislantes de la corriente eléctrica y del calor además de blandas con una temperatura de fusión y ebullición baja. Se encuentran por lo general en los tres estados.
Tipos de enlaces, metálico
En un enlace químico metálico, los átomos se mantienen unidos entre los electrones de valencia y los núcleos atómicos.
Forman estructuras compactas debido a que se mantienen agrupados de forma muy cercana ente sí.
Tipos de enlaces, valencia
La valencia es la propiedad que tienen los átomos puesto de manifiesto al combinarse entre sí para formar un compuesto estable.
La energía de esta unión se mide por el calor puesto en libertad al formar la combinación.
Los metales se clasifican en:
Monovalentes:
Potasio: K
Sodio: Na
Plata: Ag
Litio: Li
Bivalentes:
Calcio: Ca
Bario: Ba
Radio: Ra
Magnesio: Mg
Cinc: Zn
Plomo: Pb
Cobre: Cu
Mercurio: Hg
Hierro: Fe
Níquel: Ni
Manganeso: Mn
Cromo: Cr
Trivalentes:
Oro: Au
Bismuto: Bi
Aluminio: Al
Tetravalentes:
Platino: Pt
Estaño: Sn
Los no metales se clasifican en:
Monovalentes:
Flúor: F
Cloro: Cl
Bromo: Br
Yodo: I
Bivalentes:
Oxígeno: O
Azufre: S
Tri o pentavalentes:
Boro (1): B
Arsénico: Ar
Fósforo: F
Nitrógeno: Ni
Antimonio: Sb
Tetra Valente:
Carbono: C
Silicio: Si
Si hablamos de la nomenclatura química nos estamos refiriendo al conjunto de leyes adoptadas para formar el nombre de los cuerpos.
Un no metal + un no metal: el elemento de valencia inferior termina en “uro”. Ejemplo: cloruro de azufre (CL2S) o cloruro de nitrógeno ((I3N)
No metal + metal: El no metal termina en “uro” Cloruro de sodio (Nlna), bromuro de potasio (BrK)
No metal + hidrógeno: da hidrácidos. El no metal termina en hídrico. Ácido clorhídrico (ClH), Ácido bromhídrico (BrH), Ácido sulfhídrico (SH2)
En los casos en que el elemento que está en una combinación binaria actuara con dos o más cuatrivalentes es necesario indicarlas con los prefijos griegos que expresan el número que va como subíndice:
Dicloruro de hierro: Cl2Fe
Tricloruro de Hierro: Cl3Fe
Tricloruro de fósforo: PC3P
Disulfuro de carbono: S2C
Triyodduro de nitrógeno: I3N
Hexafluoruro de azufre: F6S
2 respuestas a “Tipos de enlaces”
[…] constituyen las resinas acrílicas, cuyo producto más importante es el metacrilato de metilo. Lee Tipos de enlaces. […]
[…] Formuló que el núcleo es móvil y se mueve con el electrón circundando el centro de las masas de la materia. Lee también tipos de enlaces. […]