Tipos de átomos, es la porción mínima de un elemento químico que al ser combinado con otros puede construir moléculas.
Todos los de un elemento o sustancia simple son iguales entre sí y distintos de los átomos de los otros elementos.
Son clasificados según la cantidad de neutrones y protones que posee el núcleo. El elemento químico es determinado según el número atómico y el número de protones, mientras que su isótopo es determinado por el número de neutrones. Será eléctricamente neutro en el caso de que el número de protones y electrones sea el mismo. Será ion si posee un exceso de electrones o protones, pues su carga será negativa o positiva.
Tipos de átomos, hidrogenoides
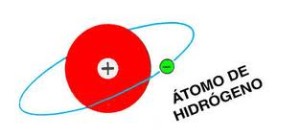
Son tipos de átomos compuestos por un solo electrón y un núcleo. Es isoelectrónico en cuanto al átomo de hidrógeno, lo cual le otorga un parecido comportamiento, varios de los exóticos también cuentan con un comportamiento hidrogenoide. El hidrógeno cuenta con isótopos, cualquiera de ellos es hidrogenoide.
Tipos de átomos, intersticiales
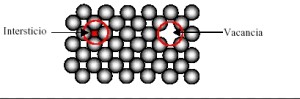
Los átomos intersticiales derivan de la acción de uno suplementario que en un mineral se ubica en su red cristalina provocando la distorsión del átomo. Este fenómeno puede ser forzado con la irradiación del cristal para otorgarle energía. De este modo se consigue que el átomo que se ubica de forma correcta en su punto de red pueda saltar para ser ubicado entre átomos que se han mantenido en su posición de red.
Tipos de átomos, exótico
Es análogo a uno normal con una o más cantidad de partículas que son reemplazadas por las elementales distintas.
Tipos de átomos, modelos
Como modelos de átomos se destacan:
El de John Dalton, quien lo formuló en 1808, fue el primero de los modelos con fundamento científico. Dalton los consideraba como elementos de la materia, indestructibles e indivisibles. A su vez afirmaba que los de un mismo elemento eran iguales entre sí con un peso propio y cualidades propias. Inclusive consideraba que los de diferentes elementos se podían combinar formando entonces varios compuestos.
El modelo Thomson:
Formulado por Joseph Thomson en 1904, fue quien descubre los electrones. Los describe como materia de forma esférica con carga positiva y en su interior posee electrones incrustados.
Tipos de átomos, Rutherfod
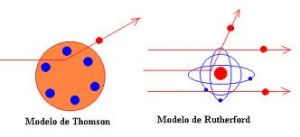
Fue Ernest Rutherford al demostrar que el átomo posee un núcleo ubicado en su centro y partes vacías rebate de esta forma el modelo de Thomson. Representa en el año 1911 a los átomos con una corteza de electrones girando alrededor del núcleo, con su mayor parte de materia y carga positiva.
El de Bohr:
Fue creado en 1913 por Niels Bohr para demostrar las órbitas estables que circundan el núcleo. A su vez demuestra los espectros de los átomos con determinadas características, incluyendo las ideas del efecto fotoeléctrico que estudió Albert Eistein.
El de Sommerfield:
Formulado por Arnold Sommerfield en 1916, a pesar de basarse en el de Bohr corrigió errores introduciendo la idea de órbitas no circulares, por el contrario formuló órbitas elípticas a una velocidad relativista.
Formuló que el núcleo es móvil y se mueve con el electrón circundando el centro de las masas de la materia. Lee también tipos de enlaces.
Una respuesta a “Tipos de átomos”
[…] El total de los átomos que corresponde al elemento químico se obtiene al multiplicar el coeficiente por el sub-índice. Te aconsejo que leas tipos de átomos. […]