Tipos de enlaces químicos; interatomico, electrovalente, covalente…
Existen los siguientes tipos de enlaces químicos:
- Enlace interatomico
- Enlace ionico o electrovalente
- Enlace covalente
- Enlace normal
- Enlace dativo o coordinado
- Enlace covalente apolar
- Enlace covalente polar
- Enlace intermoleculares
- Enlace puente de hidrogeno
Analicemos detenidamente cada unos de los tipos de enlaces químicos.
Tipos de enlaces químicos
- Enlace interatomico.- Es de aquellos tipos de enlaces químicos donde la fuerza es la que permite a los átomos estar unidos. Provocando los enlaces interatomicos gracias a la intereacción entre electrones de valencia que forman las moleculas. Por lo que el enlace puede estar o ser ionico, metalico y covalente.
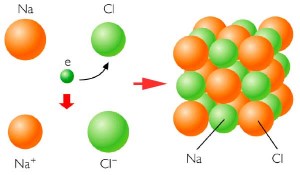
- Enlace ionico o electrovalente.- Son aquellos tipos de enlaces químicos, que poseen elementos electronegativos, ocasionando que aumenten de electrones, haciendo que se aumente hasta 8 electrones y también los electropositivos, debiendo siempre poseer su octeto. Estos enlaces ionicos cuando sea de dos o más de dos. Para muestra de lo que se explica es la fusión de ” el Cl y el Na se unen mediante enlace ionico formando una red cubica en la que se atraen cargas negativas y positivas, debido a que son enlaces muy fuertes“.
- Enlace covalente.- ocurre cuando se unen dos átomos o grupos de átomos. Pudiendo así sumar el octeto. Compartiendo los electrones del nivel ultimo. Cabe destacar que las electronegatividades en los átomos no es suficiente; siendo que los dos átomos terminan compartiendo desde uno o más pares electrónicos desde un nuevo punto orbital, también conocido como “orbital molecular”; podemos ver estos cambios solamente en estados gaseosos o de los no metales. Recuerde que podremos observar los enlaces covalentes siempre y cuando dos átomos compartan los electrones, porque solo así logran el equilibrio.
- Enlace dativo o coordinado.- Suele formarse o integrarse cuando se forma a partir de dos átomo que compartan respectivamente su par de electrones. Es notable encontrarlo cuando el átomo es no metálico y comparta su par de electrones libres en un orbital exterior, además que el átomo puede recibirlos en su ultimo nivel de valencia. Poseyendo así, la misma longitud y energía que el otro enlace. Como por ejemplo:
Enlace sencillo: comparten 1 par de electrones.
Enlace doble: comparten 2 pares de electrones.
Enlace triple: comparten 3 pares de electrones.
- Enlace covalente apolar.- Son las moléculas existen por la unión entre átomos que tiene la misma electronegatividad, siendo así que las fuerzas con las que los átomos lo conforman, esta molécula atraen a los electrones del enlace sean iguales. La molécula es polar cuando uno de sus orillas estén en positivo, y el otro negativo. No olvide, que cuando una molécula es apolar, Las cargas no existen.
- Enlace intermoleculares.- Ocurre entre un átomo de H de una molécula, que por ir unido a F, O ó N siendo que los 3 átomos más electronegativos, poseen gran densidad de carga positiva, y un átomo de F, O ó N de otra molécula que tendrá una gran densidad de carga negativa:
- Enlace puente de hidrógeno.- Es la atracción de un átomo electronegativo con uno de átomo de hidrógeno unido covalentemente a otro átomo electronegativo; dando como resultado la formación de una fuerza dipolo-dipolo.